CRISPR/Cas9系统是一种原核生物的免疫系统,是细菌用来抵抗病毒和外源质粒入侵的一种防御机制。目前最成熟且应用最广的是Type II的CRISPR/Cas9系统,其原理是利用gRNA特异性识别靶序列,并引导Cas9核酸内切酶对靶序列的PAM上游进行切割,从而造成靶位点DNA双链断裂,随之利用细胞的非同源末端连接(NHEJ)或同源重组(HDR)的方式对切割位点进行修复,实现DNA水平的敲除、敲入或点突变。
慢病毒(Lentivirus)包装所用载体是以 HIV-1 (人类免疫缺陷1型病毒)为基础,使用疱疹病毒VSVG 外壳蛋白发展起来的工具载体。由于其毒性基因已经被剔除并被外源性目的基因所取代,且不具有自我增殖的能力,属于假型病毒。慢病毒具有感染谱广泛特点,并且可以有效感染分裂和非分裂细胞。侵染宿主细胞后,慢病毒利用反转录酶将其RNA转录成双链DNA,随后永久的整合到宿主细胞的染色体中,实现长时间稳定表达。 此外,慢病毒免疫原性低,不易造成免疫反应,所以现在慢病毒系统除了被广泛应用到各种细胞系、活体动物实验中。
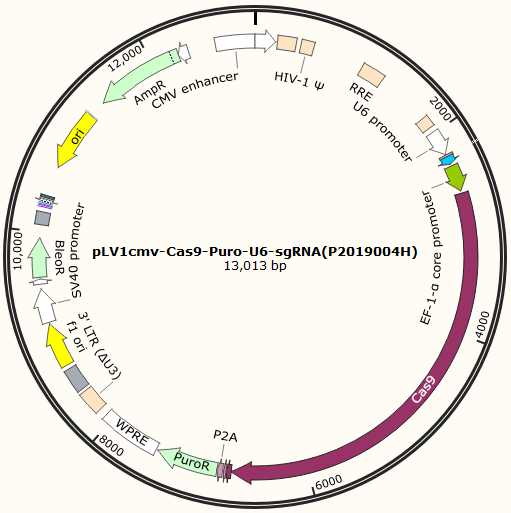
敲除慢病毒即通过慢病毒将CRISPR/Cas9系统所需要的元件整合到目的细胞中,实现高效、长时间的发挥Cas9功能,实现有效敲除,避免了瞬转时的转染试剂的摸索、敲除效率低等问题。
三保一,最多6个位点,基本实现99.9%的敲除有效
在多种细胞、物种中验证有效